
产品货号:
WH0205
中文名称:
文库定量试剂盒(illumina)
英文名称:
DNA Quantification Kit(illumina)
产品规格:
500×20μl
发货周期:
1~3天
产品价格:
询价
本试剂盒是通过SYBR Green I嵌合荧光qPCR法进行Illumina平台下高通量测序文库浓度测定的专用试剂盒。具体的工作原理是以Illumina P5和P7芯片结合序列为引物,利用试剂盒提供的6个标准品绘制标准曲线,再根据标准曲线通过绝对定量法来计算待测文库的浓度。
本试剂盒提供了文库定量所需的所有组分,其中的2×Quant MasterMix (SYBR Green)采用了抗体修饰的热启动型Taq DNA聚合酶,配合添加了H-compete因子和EP组分的qPCR Buffer体系,使得qPCR预混液具有广泛的样本普适性,同时还具有扩增效率高,检测特异性好、GC含量适应性广、检测灵敏度高等特点,最大程度的保障了文库浓度定量的准确性和重复性。
试剂盒中提供的标准品共分为6个梯度,覆盖区间为20 pM~0.0002 pM,梯度间的浓度差别为10倍,标准品为线性双链DNA片段,片段大小为449 bp,GC含量为51.2%。
试剂盒中提供的10×qPCR Primer Mix中的引物是根据Illumina P5和P7芯片结合序所设计,包括如下两种引物:
Primer 1:5'-AATGATACGGCGACCACCGA-3';
Primer 2:5'-CAAGCAGAAGACGGCATACGA-3'。
同时,试剂盒还提供了用于文库样品稀释的10×Library Dilution Buffer,方便客户对文库样品进行定量前的稀释。此外,本试剂盒不但可用于文库样品的定量,还可用于检测实验环境中文库污染的程度。
产品特点:
·简便快速:试剂盒提供了用于文库定量的所有试剂,操作简便快速,与上游建库试剂盒兼容性好;
·定量准确:检测试剂扩增效率高,特异性好,在0.0002 pM~20 pM范围内均有很好的线性关系;
·适应广泛:试剂盒提供的qPCR试剂具有良好的GC含量和扩增片段大小普适性。
试剂盒组成:
保存条件:收到本产品后,请立即置于-20℃避光保存。从-20℃取出使用时,将冻存的组分融解,然后轻轻颠倒混匀,待溶液完全均一后再行使用。如解冻后没有使用,须彻底混匀后重新冷冻。(在解冻过程中盐会出现分层现象,未混匀进行冷冻,盐晶体的析出将会对酶造成损害)。如需一段时间内经常取用,可在2~8℃条件下储存3个月。避免反复多次冻融。
注意事项:(请务必在使用本试剂盒之前阅读此注意事项)
1.关于移液
①所有试剂在使用前需解冻充分,震荡混匀并短暂离心收集液体后再开盖使用;
②尽量避免使用排枪,尽量使用带滤芯的枪头。
2.1×Library Dilution Buffer的准备
用无核酸酶污染的超纯水或者分子生物学级别的水来稀释Library Dilution Buffer,不要用DEPC处理的水或自来水来稀释。可根据实际用量选择Library Dilution Buffer的稀释量,1×Library Dilution Buffer可在2-8℃条件下保存6个月。
3.文库的浓度和稀释度
文库必须稀释至标准曲线有效CT值范围内才能进行定量分析。计算浓度时,有效CT值范围之外的CT值不可用于计算。若文库只有一个稀释度,则需重新稀释至合适浓度后再次进行定量;若文库有多个稀释梯度,则可选取落在有效范围内的CT值进行浓度计算。标准曲线有效CT值范围选取方案参见“数据分析部分”。文库稀释可参照过往经验或使用其他测定方式测定的浓度作为参考进行。下表为可定量文库浓度范围:
4.文库的稀释
利用准备好的1×Library Dilution Buffer对文库样品进行稀释,请勿使用水作为稀释液。高浓度DNA溶液粘稠,DNA分散度较差,要避免直接进行大体积稀释(比如一次性稀释10,000倍),推荐进行多次小体积稀释。比如:若需要对文库进行10,000倍稀释,则可将文库进行两次100倍的连续稀释。文库应该现用现稀释,用完丢弃。qPCR反应之前,应将稀释后的文库和解冻后的DNA Standards置于冰上存放。
5.污染预防与无模板阴性对照(NTC,No Template Control)
①为防止PCR产物污染造成定量结果不准确、可信度不高等问题,推荐将反应体系配制区和模板制备区进行物理隔离、使用专用的移液器等设备、使用带滤芯的枪头、并定时对各实验区域进行清洁。
②反应体系配制过程中DNA Standards和不同稀释度文库样品的加入应按照从低浓度至高浓度的顺序进行,并且每次移液都应更换新的枪头,以避免气溶胶污染。
③每次实验都应进行NTC阴性对照反应,并结合熔解曲线进行扩增特异性和体系污染程度分析。由于检测引物为P5/P7相关的通用引物而非特异引物,且反复进行文库稀释和定量时的气溶胶污染无法完全避免,因此NTC反应出现扩增并且产生CT值应属正常情况。数据分析时,可先根据NTC起峰情况确定标准曲线有效CT值范围(方案参见“数据分析部分”),再进行标准曲线绘制和文库浓度计算。
6.扩增曲线基线设置
由于标准品1的浓度远高于常规qPCR模板,其CT值会非常小(一般为7~9)。而大部分qPCR仪器都会默认将3~15循环设置为基线,因此有时会造成标准品1的CT值错误,进而影响标准曲线的线性关系。手动设置基线为1~3循环可以有效避免这种情况的发生。
7.文库分子长度校正
荧光染料SYBR Green I结合DNA后产生的荧光强度与DNA分子量成正比。例如:两个
300 bp的双链DNA分子产生的荧光强度与一个600 bp的双链DNA分子产生的荧光强度相当。因此,在进行文库浓度绝对定量时,必须根据标准品DNA的长度(449 bp)和文库平均长度对文库摩尔浓度进行长度矫正(方案参见“数据分析部分”)。
8.熔解曲线分析
熔解曲线在判断扩增特异性、污染程度分析以及确认标准曲线最大有效CT值时至关重要,因此建议客户每次实验都应进行熔解曲线采集步骤。DNA标准品产生的熔解曲线呈现特征双峰(下图紫色箭头标记),这种情况是DNA标准品的不同位置在不同温度下解链而造成,并不是非特异性扩增产物。此外,前3个DNA标准品的浓度极高,循环结束时扩增产物过多,会导致部分产物在Tm值附近无法完全解链。因此,前3个DNA标准品产生的熔解曲线有时会出现翘尾现象(下图红色箭头标记),属正常情况。
9.其他定量方法的关系
高通量测序文库有多种浓度测定方式,如光谱测定法(NanoDropTM等)、荧光染料法(Qubit?、PicoGreen?等)、电泳检测法(2100 Bioanalyzer、TapeStation、LabChip? GX等)、
qPCR检测法等。其中,qPCR检测法因只测定可扩增文库(双端接头完整),因此测定值与真实值最接近。一般来说,qPCR法测定的文库浓度会比其他方法略低一些,可使用其他方法粗略测定的文库浓度作为参考,选取合适的文库稀释度进行qPCR法浓度测定。然而,当文库被过度扩增时(如扩增循环数太多),也会导致qPCR法测定的文库浓度比其他方法高一些(非特异性扩增产物的干扰)。此时,若使用其他方法粗略测定的文库浓度作为稀释参考,会出现文库稀释度不足的情况。
一、操作步骤:
1.准备适量1×Library Dilution Buffer (参见注意事项中“1×Library Dilution Buffer的准备”部分)。1×Library Dilution Buffer可在2~8℃条件下保存6个月,用完后放回2~8℃条件下保存。
2.使用1×Library Dilution Buffer将待测文库进行适度稀释。文库浓度不同,最佳稀释倍数也不尽相同。推荐稀释度为1/1,000~1/100,000,并至少设置一个额外的2倍稀释,如1/10,000和1/20,000。文库应现用现稀释,稀释后置于冰上备用,用完丢弃。
3.将2×Quant MasterMix (SYBR Green)、10×qPCR Primer Mix、50×ROX Dye (如需要)、DNA Standard 1~6和RNase-Free ddH2O解冻,解冻后上下颠倒充分混匀,并短暂离心将溶液收集至管底,置于冰上备用。用完后立即放回-20℃保存。
4.按下表体系进行qPCR反应体系配制:
注意:△1几种常见仪器的最适ROX Reference Dye浓度见下表:
注意:△2推荐进行20 μl反应。如需进行10 μl反应,可将体系各组分等比减少即可。
5.按下表体系进行qPCR反应程序设置:
注意:△3若文库平均长度超过600 bp,应将退火延伸时间由45 sec延长至90 sec。
二、数据分析
1.标准曲线制作
根据复孔间CT值差异≤0.2的原则,对DNA Standards原始CT值进行筛选,并计算平均CT值。CT值筛选过程中,若其中两个复孔的CT值比较接近,并且与第三个复孔之间的CT值差异较大,那么可删除第三个复孔的数据,使用前两个复孔的CT值计算平均CT值。若三个复孔之间的CT值差异均超过0.2,则需重复实验。
2.根据NTC的CT值确认标准曲线CT值的有效范围
可根据下表内容判断标准曲线CT值的有效范围,其中S1-6代表DNA Standard 1~6:
3.绘制标准曲线
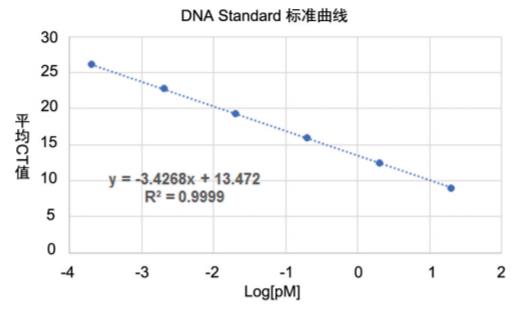
使用有效范围内DNA标准品的CT值(作为纵坐标)和对应DNA标准品浓度的Log值(作为横坐标)绘制标准曲线。绘制的标准曲线相关系数中,R2应不低于0.99,斜率应位于-3.1~-3.6之间(表示扩增效率位于90%~110%之间)。如标准曲线参数不佳,应重复试验。
三、文库浓度计算
1.根据复孔间CT值差异≤0.2的原则,对文库原始CT值进行筛选,并计算平均CT值。CT值筛选过程中,若其中两个复孔的CT值比较接近,并且与第三个复孔之间的CT值差异较大,那么可删除第 三个复孔的数据,使用前两个复孔的CT值计算平均CT值。若三个复孔之间的CT值差异均超过0.2,则需重复实验。
2.根据标准曲线计算稀释文库的浓度(pM)。
稀释文库的CT值只有位于标准曲线有效CT值范围之内才可用于浓度计算。请勿使用标准曲线有效CT值范围之外的CT值计算稀释文库的浓度。
3.根据下述公式对稀释文库的浓度(pM)进行长度矫正。
矫正后的稀释文库浓度(pM) =[449 bp/文库平均长度(bp)]×稀释文库的浓度(pM)
4.根据下述公式计算原始文库浓度(nM)。
原始文库浓度(nM) =矫正后的稀释文库浓度(pM)×稀释倍数/1,000
四、参考实例
1.初始材料
利用BaiSeq DirectFast DNA Library Prep Kit (illumina) (WH0203)制备的三个插入长度约300 bp的DNA文库(文库总长度~420 bp)。经Agilent Bioanalyzer 2100 High Sensitivity DNA Assay检测获得文库的长度、浓度。具体信息见后续数据分析表。
2.文库稀释与标准曲线的绘制
将三个文库分别用制备好的1×Library Dilution Buffer进行1/10,000稀释(两次1/100)和1/20,000稀释(1/10,000稀释产物再稀释一倍)。
qPCR反应结束后,经过对DNA Standards原始CT值的筛选和标准曲线CT值有效范围的确定,进而绘制DNA标准品的标准曲线,具体数据和筛选过程如下表所示:
注意*1:10倍梯度稀释的标准品,△CT值应处于3.1~3.6之间。
注意*2:根据复孔间CT值差异≤0.2的原则,删掉该数据。
根据上表中的数据,绘制的标准曲线如下图所示:
3.文库稀释与标准曲线的绘制
qPCR反应结束后,经过对待测样品CT值数据的筛选后,将合理数据代入到标准曲线中计算待测文库的浓度,具体数据、筛选过程和计算过程如下表所示:
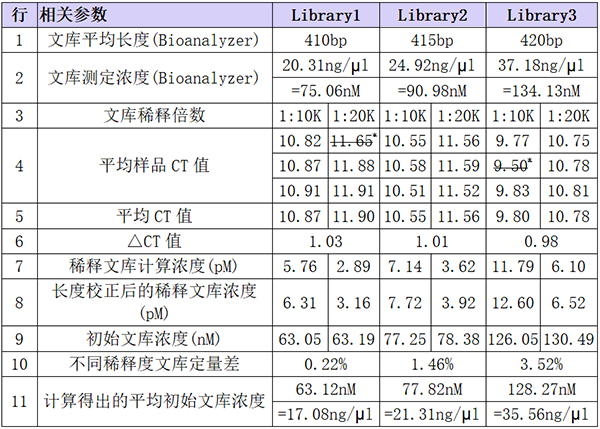
注意*:根据复孔间CT值差异≤0.2的原则,删掉这两个数据。
至此,使用本产品用于文库浓度测定的计算过程已完成。客户可根据上述参考实例来进行实验过程中文库浓度的测定。
常见问题及解决办法:
相关搜索:文库定量试剂盒(illumina),DNA Quantification Kit(illumina)
本试剂盒提供了文库定量所需的所有组分,其中的2×Quant MasterMix (SYBR Green)采用了抗体修饰的热启动型Taq DNA聚合酶,配合添加了H-compete因子和EP组分的qPCR Buffer体系,使得qPCR预混液具有广泛的样本普适性,同时还具有扩增效率高,检测特异性好、GC含量适应性广、检测灵敏度高等特点,最大程度的保障了文库浓度定量的准确性和重复性。
试剂盒中提供的标准品共分为6个梯度,覆盖区间为20 pM~0.0002 pM,梯度间的浓度差别为10倍,标准品为线性双链DNA片段,片段大小为449 bp,GC含量为51.2%。
试剂盒中提供的10×qPCR Primer Mix中的引物是根据Illumina P5和P7芯片结合序所设计,包括如下两种引物:
Primer 1:5'-AATGATACGGCGACCACCGA-3';
Primer 2:5'-CAAGCAGAAGACGGCATACGA-3'。
同时,试剂盒还提供了用于文库样品稀释的10×Library Dilution Buffer,方便客户对文库样品进行定量前的稀释。此外,本试剂盒不但可用于文库样品的定量,还可用于检测实验环境中文库污染的程度。
产品特点:
·简便快速:试剂盒提供了用于文库定量的所有试剂,操作简便快速,与上游建库试剂盒兼容性好;
·定量准确:检测试剂扩增效率高,特异性好,在0.0002 pM~20 pM范围内均有很好的线性关系;
·适应广泛:试剂盒提供的qPCR试剂具有良好的GC含量和扩增片段大小普适性。
试剂盒组成:
| 组分 | 规格 |
| 2×Quant MasterMix (SYBR Green) | 4×1.25ml |
| 10×Library Dilution Buffer | 2×1 ml |
| 10×qPCR Primer Mix | 1 ml |
| DNA Standard 1(20 pM) | 100μl |
| DNA Standard 2(2 pM) | 100μl |
| DNA Standard 3(0.2 pM) | 100μl |
| DNA Standard 4(0.02 pM) | 100μl |
| DNA Standard 5(0.002 pM) | 100μl |
| DNA Standard 6(0.0002 pM) | 100μl |
| 50×ROX Reference Dye | 1 ml |
| Nuclease-Free ddH2O | 5×1ml |
保存条件:收到本产品后,请立即置于-20℃避光保存。从-20℃取出使用时,将冻存的组分融解,然后轻轻颠倒混匀,待溶液完全均一后再行使用。如解冻后没有使用,须彻底混匀后重新冷冻。(在解冻过程中盐会出现分层现象,未混匀进行冷冻,盐晶体的析出将会对酶造成损害)。如需一段时间内经常取用,可在2~8℃条件下储存3个月。避免反复多次冻融。
注意事项:(请务必在使用本试剂盒之前阅读此注意事项)
1.关于移液
①所有试剂在使用前需解冻充分,震荡混匀并短暂离心收集液体后再开盖使用;
②尽量避免使用排枪,尽量使用带滤芯的枪头。
2.1×Library Dilution Buffer的准备
用无核酸酶污染的超纯水或者分子生物学级别的水来稀释Library Dilution Buffer,不要用DEPC处理的水或自来水来稀释。可根据实际用量选择Library Dilution Buffer的稀释量,1×Library Dilution Buffer可在2-8℃条件下保存6个月。
3.文库的浓度和稀释度
文库必须稀释至标准曲线有效CT值范围内才能进行定量分析。计算浓度时,有效CT值范围之外的CT值不可用于计算。若文库只有一个稀释度,则需重新稀释至合适浓度后再次进行定量;若文库有多个稀释梯度,则可选取落在有效范围内的CT值进行浓度计算。标准曲线有效CT值范围选取方案参见“数据分析部分”。文库稀释可参照过往经验或使用其他测定方式测定的浓度作为参考进行。下表为可定量文库浓度范围:
| 浓度类型 | 有效范围 |
| 摩尔浓度 | 20 pM~0.0002 pM |
| 质量浓度 | 5.93pg/μl~5.93×10-5pg/μl |
| 拷贝数浓度 | 1.20×107copys/μl~1.20×102copys/μl |
4.文库的稀释
利用准备好的1×Library Dilution Buffer对文库样品进行稀释,请勿使用水作为稀释液。高浓度DNA溶液粘稠,DNA分散度较差,要避免直接进行大体积稀释(比如一次性稀释10,000倍),推荐进行多次小体积稀释。比如:若需要对文库进行10,000倍稀释,则可将文库进行两次100倍的连续稀释。文库应该现用现稀释,用完丢弃。qPCR反应之前,应将稀释后的文库和解冻后的DNA Standards置于冰上存放。
5.污染预防与无模板阴性对照(NTC,No Template Control)
①为防止PCR产物污染造成定量结果不准确、可信度不高等问题,推荐将反应体系配制区和模板制备区进行物理隔离、使用专用的移液器等设备、使用带滤芯的枪头、并定时对各实验区域进行清洁。
②反应体系配制过程中DNA Standards和不同稀释度文库样品的加入应按照从低浓度至高浓度的顺序进行,并且每次移液都应更换新的枪头,以避免气溶胶污染。
③每次实验都应进行NTC阴性对照反应,并结合熔解曲线进行扩增特异性和体系污染程度分析。由于检测引物为P5/P7相关的通用引物而非特异引物,且反复进行文库稀释和定量时的气溶胶污染无法完全避免,因此NTC反应出现扩增并且产生CT值应属正常情况。数据分析时,可先根据NTC起峰情况确定标准曲线有效CT值范围(方案参见“数据分析部分”),再进行标准曲线绘制和文库浓度计算。
6.扩增曲线基线设置
由于标准品1的浓度远高于常规qPCR模板,其CT值会非常小(一般为7~9)。而大部分qPCR仪器都会默认将3~15循环设置为基线,因此有时会造成标准品1的CT值错误,进而影响标准曲线的线性关系。手动设置基线为1~3循环可以有效避免这种情况的发生。
7.文库分子长度校正
荧光染料SYBR Green I结合DNA后产生的荧光强度与DNA分子量成正比。例如:两个
300 bp的双链DNA分子产生的荧光强度与一个600 bp的双链DNA分子产生的荧光强度相当。因此,在进行文库浓度绝对定量时,必须根据标准品DNA的长度(449 bp)和文库平均长度对文库摩尔浓度进行长度矫正(方案参见“数据分析部分”)。
8.熔解曲线分析
熔解曲线在判断扩增特异性、污染程度分析以及确认标准曲线最大有效CT值时至关重要,因此建议客户每次实验都应进行熔解曲线采集步骤。DNA标准品产生的熔解曲线呈现特征双峰(下图紫色箭头标记),这种情况是DNA标准品的不同位置在不同温度下解链而造成,并不是非特异性扩增产物。此外,前3个DNA标准品的浓度极高,循环结束时扩增产物过多,会导致部分产物在Tm值附近无法完全解链。因此,前3个DNA标准品产生的熔解曲线有时会出现翘尾现象(下图红色箭头标记),属正常情况。
9.其他定量方法的关系
高通量测序文库有多种浓度测定方式,如光谱测定法(NanoDropTM等)、荧光染料法(Qubit?、PicoGreen?等)、电泳检测法(2100 Bioanalyzer、TapeStation、LabChip? GX等)、
qPCR检测法等。其中,qPCR检测法因只测定可扩增文库(双端接头完整),因此测定值与真实值最接近。一般来说,qPCR法测定的文库浓度会比其他方法略低一些,可使用其他方法粗略测定的文库浓度作为参考,选取合适的文库稀释度进行qPCR法浓度测定。然而,当文库被过度扩增时(如扩增循环数太多),也会导致qPCR法测定的文库浓度比其他方法高一些(非特异性扩增产物的干扰)。此时,若使用其他方法粗略测定的文库浓度作为稀释参考,会出现文库稀释度不足的情况。
一、操作步骤:
1.准备适量1×Library Dilution Buffer (参见注意事项中“1×Library Dilution Buffer的准备”部分)。1×Library Dilution Buffer可在2~8℃条件下保存6个月,用完后放回2~8℃条件下保存。
2.使用1×Library Dilution Buffer将待测文库进行适度稀释。文库浓度不同,最佳稀释倍数也不尽相同。推荐稀释度为1/1,000~1/100,000,并至少设置一个额外的2倍稀释,如1/10,000和1/20,000。文库应现用现稀释,稀释后置于冰上备用,用完丢弃。
3.将2×Quant MasterMix (SYBR Green)、10×qPCR Primer Mix、50×ROX Dye (如需要)、DNA Standard 1~6和RNase-Free ddH2O解冻,解冻后上下颠倒充分混匀,并短暂离心将溶液收集至管底,置于冰上备用。用完后立即放回-20℃保存。
4.按下表体系进行qPCR反应体系配制:
| 成分 | 20μl体系 | 终浓度 |
| 2×Quant MasterMix (SYBR Green) | 10μl | 1× |
| 10×qPCR Primer Mix | 2μl | 1× |
| DNA Standard 1~6或稀释后的文库或灭菌蒸馏水 | 4μl | - |
| 50×ROX Reference Dye△1 | - | - |
| Nuclease-Free ddH2O△2 | 至20μl | - |
注意:△1几种常见仪器的最适ROX Reference Dye浓度见下表:
| 仪器 | 浓度 |
| ABI PRISM 7000/7300/7700/7900HT/StepOne等 | 2×(例如:5 μl ROX/20 μl体系) |
| ABI 7500、7500 Fast、ViiA 7; Stratagene Mx3000P、Mx3005P和Mx4000等 | 1×(例如:0.4 μl ROX/20 μl体系) |
| Roche仪器,Bio-Rad仪器,Eppendorf仪器等 | 无需添加 |
注意:△2推荐进行20 μl反应。如需进行10 μl反应,可将体系各组分等比减少即可。
5.按下表体系进行qPCR反应程序设置:
| 阶段 | 循环 | 温度 | 时间 | 内容 | 荧光信号采集 |
| 预变性 | 1× | 95℃ | 5min | 预变性 | 否 |
| PCR反应 | 35× | 95℃ | 30sec | 变性 | 否 |
| 60℃ | 45sec△3 | 退火/延伸 | 是 | ||
| 熔解曲线分析(Melting/Dissociation Curve Stage) | |||||
注意:△3若文库平均长度超过600 bp,应将退火延伸时间由45 sec延长至90 sec。
二、数据分析
1.标准曲线制作
根据复孔间CT值差异≤0.2的原则,对DNA Standards原始CT值进行筛选,并计算平均CT值。CT值筛选过程中,若其中两个复孔的CT值比较接近,并且与第三个复孔之间的CT值差异较大,那么可删除第三个复孔的数据,使用前两个复孔的CT值计算平均CT值。若三个复孔之间的CT值差异均超过0.2,则需重复实验。
2.根据NTC的CT值确认标准曲线CT值的有效范围
可根据下表内容判断标准曲线CT值的有效范围,其中S1-6代表DNA Standard 1~6:
| NTC的CT值 | 最大有效CT值 | CT可用的标准品梯度 |
| CT(NTC)>CT(S6)+3 | CT(S6) | S1-6 |
| CT(S6)+3>CT(NTC)>CT(S5)+3 | CT(S5) | S1-5 |
| CT(S5)+3>CT(NTC)>CT(S4)+3 | CT(S4) | S1-4 |
| CT(S4)+3>CT(NTC)>CT(S3)+3 | 体系存在污染,需更换体系重复实验 | |
3.绘制标准曲线
使用有效范围内DNA标准品的CT值(作为纵坐标)和对应DNA标准品浓度的Log值(作为横坐标)绘制标准曲线。绘制的标准曲线相关系数中,R2应不低于0.99,斜率应位于-3.1~-3.6之间(表示扩增效率位于90%~110%之间)。如标准曲线参数不佳,应重复试验。
三、文库浓度计算
1.根据复孔间CT值差异≤0.2的原则,对文库原始CT值进行筛选,并计算平均CT值。CT值筛选过程中,若其中两个复孔的CT值比较接近,并且与第三个复孔之间的CT值差异较大,那么可删除第 三个复孔的数据,使用前两个复孔的CT值计算平均CT值。若三个复孔之间的CT值差异均超过0.2,则需重复实验。
2.根据标准曲线计算稀释文库的浓度(pM)。
稀释文库的CT值只有位于标准曲线有效CT值范围之内才可用于浓度计算。请勿使用标准曲线有效CT值范围之外的CT值计算稀释文库的浓度。
3.根据下述公式对稀释文库的浓度(pM)进行长度矫正。
矫正后的稀释文库浓度(pM) =[449 bp/文库平均长度(bp)]×稀释文库的浓度(pM)
4.根据下述公式计算原始文库浓度(nM)。
原始文库浓度(nM) =矫正后的稀释文库浓度(pM)×稀释倍数/1,000
四、参考实例
1.初始材料
利用BaiSeq DirectFast DNA Library Prep Kit (illumina) (WH0203)制备的三个插入长度约300 bp的DNA文库(文库总长度~420 bp)。经Agilent Bioanalyzer 2100 High Sensitivity DNA Assay检测获得文库的长度、浓度。具体信息见后续数据分析表。
2.文库稀释与标准曲线的绘制
将三个文库分别用制备好的1×Library Dilution Buffer进行1/10,000稀释(两次1/100)和1/20,000稀释(1/10,000稀释产物再稀释一倍)。
qPCR反应结束后,经过对DNA Standards原始CT值的筛选和标准曲线CT值有效范围的确定,进而绘制DNA标准品的标准曲线,具体数据和筛选过程如下表所示:
| DNA Standard | Log[pM] | CT值 | 平均CT值 | △CT值*1 | ||
| 1 | Log[20] | 8.98 | 9.00 | 8.95 | 8.98 | - |
| 2 | Log[2] | 12.43 | 12.40 | 12.45 | 12.43 | 3.45 |
| 3 | Log[0.2] | 15.87 | 15.90 | 15.92 | 15.9 | 3.47 |
| 4 | Log[0.02] | 19.36 | 19.34 | 19.38 | 19.36 | 3.46 |
| 5 | Log[0.002] | 22.78 | 22.77 | 22.69 | 22.75 | 3.39 |
| 6 | Log[0.0002] | 26.09 | 26.07 | 26.33*2 | 26.08 | 3.33 |
| NTC | - | 32.04 | 32.1 | 32.03 | 32.05 | - |
注意*1:10倍梯度稀释的标准品,△CT值应处于3.1~3.6之间。
注意*2:根据复孔间CT值差异≤0.2的原则,删掉该数据。
根据上表中的数据,绘制的标准曲线如下图所示:

3.文库稀释与标准曲线的绘制
qPCR反应结束后,经过对待测样品CT值数据的筛选后,将合理数据代入到标准曲线中计算待测文库的浓度,具体数据、筛选过程和计算过程如下表所示:

注意*:根据复孔间CT值差异≤0.2的原则,删掉这两个数据。
至此,使用本产品用于文库浓度测定的计算过程已完成。客户可根据上述参考实例来进行实验过程中文库浓度的测定。
常见问题及解决办法:
| 现象 | 原因分析及解决办法 |
| 扩增效率超出 90%~110%范围 | 若NTC与6号标准品的ΔCT值小于3或者5、6号两个标准品的ΔCT值小于3.1,且计算扩增效率超过100%,那么应是反应体系有污染。可根据NTC阴性对照的熔解曲线确认污染源(文库污染或DNA Standards污染)。绘制标准曲线时,应先根据NTC的CT值确定标准曲线有效CT值范围,舍弃受污染影响的标准品,使用剩余的有效标准品绘制标准曲线。 |
| 不恰当的基线(Baseline)设置会增大DNA Standard 1的CT值,进而影响扩增效率计算。手动调整基线(Baseline)为1-3循环,可解决此问题。 | |
| 移液不准确。 | |
| R2<0.99 | 移液不准确。 |
| 所有试剂在使用前应充分解冻并彻底混匀。 | |
| 仪器相关问题。确认所用ROX Reference Dye与定量仪器匹配。 | |
| 标准品扩增 曲线分布不均一 | 若5、6两个标准品的ΔCT值小于3.1,那么应是反应体系有污染。可根据NTC阴性对照的熔解曲线确认污染源(文库污染或DNA Standards污染)。 |
| 若1、2两个标准品的ΔCT值小于3.1,那么应是基线(Baseline)设置不当。手动调整基线(Baseline)为1~3。 | |
| 若DNA Standards之间的ΔCT值大于3.6,那么提示扩增效率差。确认所有试剂在使用前都已充分解冻并彻底混匀;确认所有组分浓度正确以及反应程序无误。 | |
| 长时间强光照射会导致2×Quant MasterMix (SYBR Green)荧光下降,进而造成ΔCT大于3.6。应按照推荐方式避光贮存试剂。 | |
| 复孔重复性差 | 移液不准确。 |
| 所有试剂在使用前应充分解冻并彻底混匀。 | |
| 仪器相关问题。确认所用ROX Reference Dye与定量仪器匹配。 | |
| 待测文库各稀释度 的ΔCT值与稀释 倍数差异不一致 | 移液不准确。 |
| 所有试剂在使用前应充分解冻并彻底混匀。 | |
| 文库难于扩增。GC/AT含量过高或长度超过1 kb的文库扩增效率较差,定量波动性大。 | |
| 文库降解。文库应现用现稀释,稀释好的文库应置于冰上备用,用完丢弃。 | |
| 文库各稀释度计算 的初始文库浓度 差异超过10% | 移液不准确。 |
| 所有试剂在使用前应充分解冻并彻底混匀。 | |
| 文库难于扩增。GC/AT含量过高或长度超过1 kb的文库扩增效率较差,定量波动性大。 | |
| 文库降解。文库应现用现稀释,稀释好的文库应置于冰上备用,用完丢弃。 | |
| 稀释文库CT值超 过标准曲线有效 CT值范围 | 若稀释文库的CT值小于1号标准品的CT值,那么提示文库稀释度不够,多见于过度扩增的文库。提高文库稀释倍数重复实验。 |
| 若稀释文库的CT值大于6号标准品的CT值,那么提示文库稀释度过高或构建失败。常规文库在1/10,000左右的稀释度时得到的CT值是不会超过6号标准品的CT值的。减少稀释倍数重复实验。 | |
| 1号标准品的CT值 异常 | 不恰当的基线(Baseline)设置会增大DNA Standard 1的CT值,进而影响扩增效率计算。手动调整基线(Baseline)为1~3循环,可解决此问题。 |
| DNA Standards有 扩增,而文库没有 扩增或者CT值很大 | 文库接头序列错误,建议核对文库末端序列与试剂盒提供的引物序列是否匹配。 |
| 稀释度过高,建议减少稀释倍数,重复实验。 | |
| 文库降解,文库应现用现稀释,稀释好的文库应置于冰上备用,用完丢弃。 |
相关搜索:文库定量试剂盒(illumina),DNA Quantification Kit(illumina)



